Simulaciones de hidrógeno
- Atomo
- Molécula
Modelo atómico del hidrógeno
¿Cómo los científicos determinan la estructura de los átomos, sin mirarlos? Prueba los diferentes modelos mediante el disparo de luz en el átomo. Comprueba cómo la predicción del modelo coincide con los resultados experimentales.
Molécula de hidrógeno
El hidrógeno es el elemento químico de número atómico 1, representado por el símbolo H. Por lo general, se presenta en su forma molecular. La molécula de hidrógeno está formada por dos átomos de hidrógeno, lo que da lugar al gas diatómico H2 en condiciones normales. Este gas es inflamable, incoloro, inodoro, no metálico e insoluble en agua.
Hidrógeno
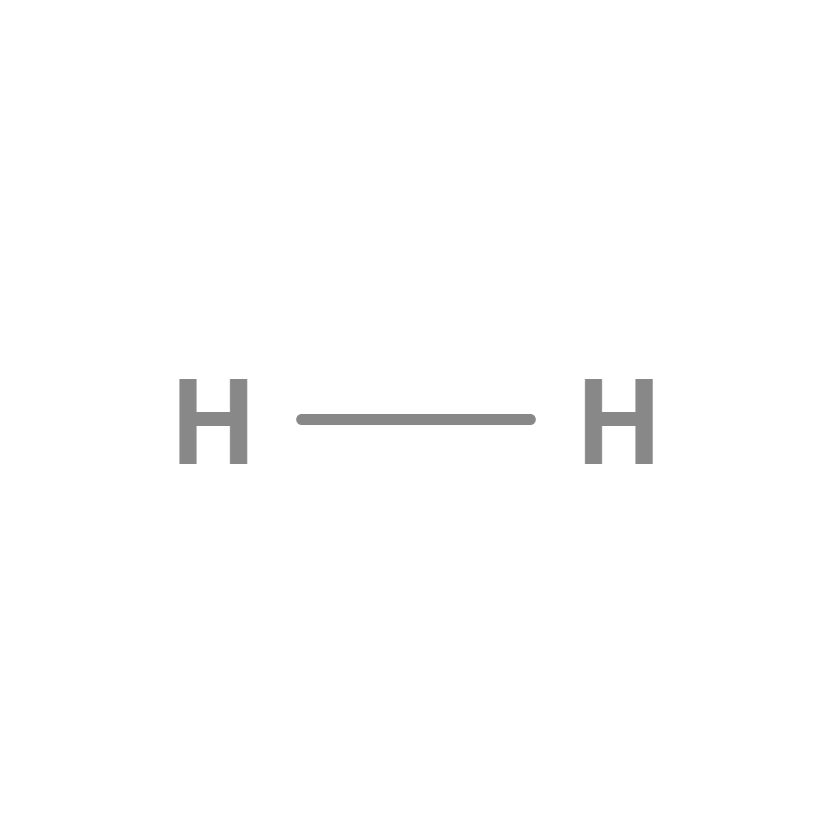
 Enlace simple
Enlace simple
Enlace doble
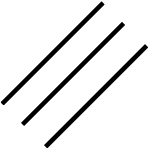 Enlace Triple
Enlace Triple
Enlace cuña

Enlace hash
- Atomo
Modelo atómico del hidrógeno
¿Cómo los científicos determinan la estructura de los átomos, sin mirarlos? Prueba los diferentes modelos mediante el disparo de luz en el átomo. Comprueba cómo la predicción del modelo coincide con los resultados experimentales.
Esta simulación Java no se puede ejecutar en este dispositivo porque tiene una pantalla demasiado estrecha. Le recomendamos que, para una mejor experiencia de usuario la ejecute en un dispositivo con pantalla más ancha
Aunque esta simulación Java se puede ejecutar en su dispositivo, le recomendamos que para una mejor experiencia de usuario, la ejecute en un dispositivo con pantalla más ancha.
Gigantes de la ciencia
«Si he visto más lejos es porque estoy a hombros de gigantes»
Isaac Newton

Dmitri Ivánovich Mendeléyev
–

William Henry
–
Hazte gigante
Tu camino para ser un gigante del conocimiento comienza con estos cursos gratuitos de primer nivel


Microcápsulas: Aplicación y Caracterización



Materiales avanzados en ingeniería derivados de laminados compuestos



Introducción a la Estructura de la Materia



Reacciones Químicas y Cálculos Estequiométricos



El Enlace Químico y las Interacciones Moleculares



Formulación y nomenclatura de compuestos químicos

Desarrollo profesional docente
Programas de formación orientados a fortalecer la práctica educativa en ciencias y tecnología


The Science of Learning – What Every Teacher Should Know



Chatbots for Instruction



Introduction to Data Wise: A Collaborative Process to Improve Learning & Teaching



Teaching With Technology and Inquiry: An Open Course For Teachers































